MEDIDA DEL
POTENCIAL HÍDRICO
I) Fundamento
El
potencial hídrico de un tejido vegetal determina la dirección e intensidad del
movimiento del agua en relación con el ambiente de la planta. El tejido que
posea un potencial hídrico bajo alejado de cero (es decir, muy negativo),
tenderá a absorber agua de su entorno, siempre que éste presente un potencial
hídrico más elevado próximo a cero (es decir, menos negativo).
El
potencial hídrico será siempre negativo (pues se ha asignado al agua pura -sin
solutos- un potencial hídrico igual a 0), y más negativo cuanto mayor sea la
concentración de solutos. Por eso el agua pasará del medio con potencial
hídrico menos negativo (con menor concentración de solutos) al que tiene potencial
hídrico más negativo (con mayor concentración de solutos), siempre que ambos
medios se encuentren separados por una membrana semipermeable (como es en el
caso de las membranas biológicas) .
Como
sabemos, el potencial hídrico (Ψ) de un sistema está determinado por tres
factores: el potencial hídrico de presión (Ψp), el potencial
matricial (Ψm) y el potencial de solutos (Ψs). En el caso de nuestro
experimento Ψp será 0 (porque P = l atm) y Ψm
será también 0 (las matrices que pueden absorber agua están constituidas por el
tejido de la planta y consideramos que se encuentran saturadas). Por eso, en
nuestro caso Ψ = Ψs
II) Material (por cada grupo o mesa)
-Tubérculo
de patata (en fragmentos de dimensiones homogéneas)
-8 tubos de
ensayo
-8 placas
de Petri
-2
gradillas
-1 pipeta
de 10 ml
-1 pipeta
de 1 ml
-Pipeta
Pasteur
-Pinzas
-Sacarosa
2 M
-Azul de
metileno
III) Procedimiento
Preparamos
una serie de 8 placas de Petri con distintas concentraciones de sacarosa. Para
eso, como Ψ = Ψs , utilizamos la fórmula
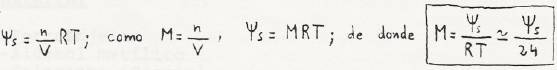
De esa
ecuación obtenemos los valores de M que precisamos para que el Ψs
(y por tanto el Ψ) de las disoluciones contenidas en las placas de
Petri sean respectivamente -3, -4, -5, -6, -7, -8, -9 y -10 atm. Tendremos
presente, al calcular la molaridad de las disoluciones, que añadiremos 3 ml de azul de metileno a
cada disolución.
Preparamos
una serie de 8 tubos de ensayo con idénticos valores de M que las placas de
Petri anteriores. El volumen final de cada disolución será de 15 ml. Añadimos a
cada tubo 10 cilindros de patata homogéneos (aprox. 1 cm de diámetro x 3 mm de longitud).
Es indispensable que los cilindros estén lavados (para eliminar la capa de
almidón que se forma al cortarlos) ligeramente (para que no varíe su Ψ),y
secos con papel de filtro.
Esperamos
entre l’5 y 2 horas. Al cabo de este tiempo retiramos los cilindros de sus
respectivos tubos y procedemos de la siguiente manera: situamos -con ayuda de
una pipeta Pasteur- 1 gota de cada solución coloreada con azul de metileno en
medio de cada tubo con idéntica concentración sin colorear:
a) Si la
gota tiende a subir es porque el medio incoloro tiene más densidad (mayor concentración de sacarosa), debido a que su
concentración de soluto era inferior a la del tejido de la patata y éste -por
ósmosis- ha absorbido agua de la disolución.
b) Si la
gota coloreada tiende a bajar es porque el medio incoloro tiene menor
concentración de sacarosa, debido a que el tejido de la patata ha cedido agua,
por ósmosis.
c) La
solución en la que la gota quede inmóvil tendrá un potencial osmótico
equivalente al potencial hídrico del tejido.
IV)
Resultados
|
Potencial osmótico
|
Soluc. de sacarosa (2M)
|
Colorante y agua (ml)
|
Movimientos de la gota
|
|
-3
|
|
|
|
|
-4
|
|
|
|
|
-5
|
|
|
|
|
-6
|
|
|
|
|
-7
|
|
|
|
|
-8
|
|
|
|
|
-9
|
|
|
|
|
-10
|
|
|
|
V) Algunos
detalles que conviene tener en cuenta
Mi experiencia dice que ésta es una
de esas prácticas que sale “una vez sí y cuatro veces no”. Además, a veces
cuesta determinar si la gota intenta ascender, descender u quedarse donde la
hemos puesto (ya que debemos dejar la gota pequeña con cuidado en suspensión en
medio del tubo, evitando desplazarla con el impulso que le damos para
expulsarla de la pipeta y evitando que se mezcle con la disolución de sacarosa
incolora en la que la ponemos). Por eso es un riesgo. Como la práctica anterior
(potencial osmótico) sirve para lo mismo, quizá sea más recomendable (aunque
tampoco viene mal hacer esta, aun con el riesgo de que salga mal: los alumnos
deben conocer que en los laboratorios no todo sale como en los libros).





